Синтезувати з сечової кислоти. Велика енциклопедія нафти і газу. Освіта ді-і трифосфатів пуринових нуклеозидів
1. Чи є потужним стимулятором центральної нервової системи, пригнічуючи фосфодіестеразу, яка служить посередником дії гормонів адреналіну і норадреналіну. Сечова кислота пролонгує (подовжує) дію цих гормонів на центральну нервову систему.
2. Володіє антиоксидантними властивостями - здатна взаємодіяти з вільними радикалами.
Гіперурикемія, індукована фруктозою, резистентність до інсуліну і діабет
Класичні та альтернативні ліпогенного шляху фруктози. Спостереження, що гальмування синтезу сечової кислоти запобігає метаболічний синдром і стеатоз печінки, призводить до питання про те, як сечова кислота може сприяти резистентності до інсуліну і діабету.
Ефекти в білій жировій тканині
Спостереження, що сечова кислота може індукувати мітохондріальний окислювальний стрес і жирову печінку, може пояснити, як фруктоза викликає резистентність до інсуліну. Сечова кислота може також індукувати резистентність до інсуліну через вплив на адипоцити. Аналогічним чином, зниження вмісту сечової кислоти або алопуринолом, або бензбромароном у щурів, які отримували фруктозу, призводить до меншої резистентності до інсуліну і зменшує надлишкову експресію лептину, яка виникає в висцеральном жирі.
Рівень сечової кислоти в організмі контролюється на генетичному рівні. Для людей з високим рівнем сечової кислоти властивий високий життєвий тонус.
Однак підвищений вміст сечової кислоти в крові ( гіперурикемія) Небезпечно. Сама сечова кислота і, особливо, її солі урати (натрієві солі сечової кислоти) погано розчиняються у воді. Навіть при незначному підвищенні концентрації вони починають починають випадати в осад і кристалізуватися, утворюючи камені. Кристали сприймаються організмом як чужорідний об'єкт. У суглобах вони фагоцитуються макрофагами, самі клітини при цьому руйнуються, з них звільняються гідролітичні ферменти. Це призводить до запальної реакції, що супроводжується сильними болями в суглобах. Таке захворювання називається подагра. Інше захворювання, при якому кристали уратів відкладаються в ниркової балії або в сечовому міхурі, відомо як мочекам'яна хвороба.
Фруктоза може також індукувати резистентність до інсуліну через вплив на судинну мережу. Гіперурикемічну щури порушують функцію ендотелію і гіпертонію, які можуть бути скасовані шляхом зниження сечової кислоти або лікування за допомогою 1 -аргініна або антиоксидантів. Гіперурикемія також пов'язана з ендотеліальної дисфункцією у людей, а зниження сечової кислоти алопуринолом покращує ендотеліальну дисфункцію при безсимптомній гіперурикемії, застійної серцевої недостатності, діабеті, хронічному захворюванні нирок, обструктивному апное уві сні і при палінні.
Для лікування подагри і сечокам'яної хвороби застосовуються:
інгібітори ферменту ксантиноксидази. Наприклад, алопуринол - речовина пуринової природи, є конкурентним інгібітором ферменту. Дія цього препарату призводить до підвищення концентрації гипоксантина. Гіпоксантин і його солі краще розчинні у воді, і легше виводяться з організму.
Хронічне застосування фруктози або сахарози для тварин не тільки викликає резистентність до інсуліну, але також може призводити до діабету типу 2. Гистологически, острівці показують гиалиноз і інфільтрацію макрофагів, аналогічну тому, що спостерігається у людей з діабетом типу 2. Вважається, що окислювальний стрес в острівцях грає важливу роль у виникненні осьової дисфункції діабету типу 2.
Докази того, що фруктоза опосередковує жирну печінку і резистентність до інсуліну у людей
Споживання цукру і безалкогольних напоїв вище в популяціях з підвищеним ризиком резистентності до інсуліну і діабет, включаючи афро-американців, вихідців з Латинської Америки, корінних американців і суб'єктів з більш низьким доходом. Клінічні дослідження підтвердили метаболічні ефекти фруктози. Хоча деякі особливості метаболічного синдрому викликалися глюкозою, у суб'єктів, які отримували фруктозу, спостерігалася гірша постпрандіальна гипертриглицеридемия, підвищений синтез жирних кислот в печінці, зниження чутливості до інсуліну, збільшення загального і вісцерального жиру, більш високі 24-годинні рівні сечової кислоти, збільшення системних запальних медіаторів і більш низькі витрати енергії на відпочинок.
дієтичне харчування, що виключає продукти, багаті нуклеїновими кислотами, пуринів і їх аналогами: ікра риб, печінка, м'ясо, кава і чай.
солі літію, оскільки вони краще розчиняються у воді, ніж урати натрію.
Синтез нуклеїнових кислот синтез мононуклеотидів
Для синтезу мононуклеотидів de novo необхідні дуже прості речовини: CO 2 і рибоза-5-фосфат (продукт 1-го етапу ГМФ-шляху). Синтез відбувається з витратою АТФ. Крім цього, необхідні замінні амінокислоти, які синтезуються в організмі, тому навіть при повному голодуванні синтез нуклеїнових кислот не страждає.
В кінці 6 місяців випробовувані, які беруть солодкі безалкогольні напої, відображали більш вісцеральні, скелетні м'язи і жири печінки, а також більш високі рівні тригліцеридів і холестерину в сироватці в порівнянні з молоком групи, що мають тенденцію до значущості в двох інших групах.
Роль сечової кислоти в резистентності до інсуліну і жирової печінки у людей
Також були проведені дослідження втручання для оцінки ефекту зниження споживання цукру при метаболічному синдромі. Як уже згадувалося, фруктоза збільшує рівень внутрішньоклітинної і циркулюючої сечової кислоти через збільшення обороту нуклеотидів і синтезу нуклеотидів. Спочатку підвищення сироваткової сечової кислоти найкраще показано незабаром після прийому фруктози, але також підвищуються загальні 24-годинні рівні.
РОЛЬ АМІНОКИСЛОТ У синтезі мононуклеотидів
аспарагин. Є донором амидной групи.
аспарагінова кислота.
а) Чи є донором аміногрупи
гліцин
а) Чи є донором активного З 1.
б) Бере участь в синтезі всієї молекулою.
Серін. Є донором активного З 1.
ПЕРЕНЕСЕННЯ одинвуглецевого ФРАГМЕНТІВ
Крім того, метаболічний синдром пов'язаний з високою частотою гіперурикемії, а також гіперурикемія пов'язана з метаболічним синдромом. Сироватка сечової кислоти пророкує розвиток діабету. Ряд станів, пов'язаних з гіперурикемією, також пов'язані з підвищеним ризиком резистентності до інсуліну або діабет, включаючи хронічну інтоксикацію свинцем і гестаційний цукровий діабет. Багато препаратів, пов'язані з резистентністю до інсуліну, також пов'язані з гіперурикемією, такими як інгібітори кальциневрину і тіазидні діуретики.
Освіта АМР і GMP з IMP
Доказ того, що зниження вмісту сечової кислоти може поліпшити резистентність до інсуліну у людей, обмежена. Очевидно, що до тих пір, поки не будуть зроблені остаточні висновки щодо зниження вмісту сечової кислоти для лікування резистентності до інсуліну, буде вказано більше досліджень.
В організмі людини існують ферменти, які можуть витягувати з деяких амінокислот З 1 -группу. Такі ферменти є складними білками. Як коферменту містять похідне вітаміну В З - фолієвої кислоти. Фолієвої кислоти багато в зеленому листі, до того ж, цей вітамін синтезується мікрофлорою кишечника. У клітинах організму фолієва кислота (ФК) двічі відновлюється (до неї приєднується водень) за участю ферменту НАДФ . Н 2 -залежною редуктази, І перетворюється в тетрагідрофолієву кислоту (ТГФК).
Проблеми з гіпотезою фруктози і сечової кислоти
Гіпотеза гіперурикемії, викликана фруктозою, була поставлена під сумнів. Однак використовується очищена фруктоза, тому можна відокремити ефекти фруктози від глюкози. Уриказа деградує сечову кислоту до алантоїн, і, як наслідок, щури швидко розкладають сечову кислоту після її утворення в печінці.
Клінічні дослідження: важливість контрольної групи
Нещодавно ряд дослідників представили метааналізи, які припускають, що фруктоза не має причинно-наслідкового зв'язку з ожирінням або метаболічним синдромом. Перш ніж аналізувати ці дослідження, важливо зрозуміти складність, пов'язану з їх інтерпретацією. По-перше, у багатьох клінічних дослідженнях використовується тільки фруктоза - і часто при відносно високих дозах - для оцінки впливу фруктози як такої. Це дозволяє безпосередньо реагувати на ефекти фруктози, а використання високих доз - загальний експериментальний підхід, що дозволяє ідентифікувати метаболічні ефекти, які в іншому випадку могли б зайняти набагато триваліші періоди.
Активний З 1 витягується з гліцину або серину.
У каталітичному центрі ферменту, що містить ТГФК, є дві -NH-групи, які беруть участь у зв'язуванні активного З 1. Схематично процес можна уявити так:

НАДН 2, який утворюється в зворотної реакції, може бути використаний для відновлення пірувату в лактат (гліколітична оксідоредукція). Реакція каталізується ферментом гліцінсінтетазой. Після цього метилен-ТГФК відділяється від білкової частини ферменту, і потім можливі два варіанти її перетворень:
Проте, введення тільки фруктози може бути дуже важко інтерпретувати, тому що поглинання фруктози, якщо вона дана окремо, досить мінлива. Цілих дві третини дітей і одна третина дорослих мальабсорб фруктози. Ще одна ключова проблема полягає в тому, чи повинні дослідження, що оцінюють фруктозу, включати фруктозу з натуральних фруктів. Можна стверджувати, що фруктоза є фруктозою незалежно від джерела, але природні фрукти також містять безліч речовин, які блокують ефекти фруктози, включаючи калій, вітамін С і антиоксиданти, такі як ресвератрол, кверцетин та інші флавоноли.
Метилен-ТГФК може стати небелковой частиною ферментів синтезу мононуклеотидів.
Метиленова угруповання може видозмінюватися до:
Ці угруповання пов'язані тільки з одним з атомів азоту ТГФК, але теж можуть стати субстратами для синтезу мононуклеотидів.
Тому будь-яка з угрупувань, пов'язана з ТГФК, називається активним З 1.
Ще одна важлива проблема полягає в тому, чи є сама глюкоза правильним контролем для фруктози. Зокрема, високі концентрації глюкози, наприклад, в безалкогольних напоях, можуть стимулювати активацію поліольного шляху в печінки, приводячи до утворення фруктози. Отже, хоча сама фруктоза матиме більше метаболічних ефектів, ніж глюкоза, сама глюкоза також може викликати метаболічні зміни через фруктозу.
Мета-аналізи, які стверджують, фруктоза не є фактором ризику метаболічного синдрому
Проте, ніяка їжа не призведе до збільшення ваги в цих умовах, оскільки збільшення ваги обумовлено насамперед збільшенням споживання енергії, на відміну від зниження швидкості метаболізму, по крайней мере, в короткостроковій перспективі. Дійсно, механізм, за допомогою якого фруктоза збільшує вагу, ймовірно, завдяки його здатності стимулювати реакцію голоду і блоку ситості, тому, якщо споживання їжі контролюється, це не буде спостерігатися.
Для синтезу будь-якого з нуклеотидів потрібно активна форма рибоза-фосфату - фосфорібозілпірофосфат (ФРПФ), що утворюється в наступній реакції:

Фосфорібозілпірофосфаткіназа (ФРПФ-кіназа) є ключовим ферментом для синтезу всіх мононуклеотидів. Відзначено зниження цей фермент за принципом негативного зворотного зв'язку надлишком АМФ і ГМФ. При генетичному дефекті ФРПФ-кінази спостерігається втрата чутливості ферменту до дії своїх інгібіторів. В результаті зростає продукція пуринових мононуклеотидів, а, значить, і швидкість їх руйнування, що призводить до збільшення концентрації сечової кислоти - спостерігається подагра.
Оскільки гострі ефекти фруктози для підвищення артеріального тиску виникають під час прийому фруктози, не дивно, що автори не виявляли впливу на кров'яний тиск; дійсно, аналогічно розроблене дослідження укладатиме, що багаті глюкозою дієти не підвищують рівень інсуліну.
Важливим питанням є те, чи може хронічне вживання фруктози бути відповідальним за постійні підвищення артеріального тиску. Відомо, що найбільший ризик для стійкої гіпертензії - прикордонна гіпертензія, в якій відбуваються переривчасті підвищення артеріального тиску. Є також дані про те, що фруктоза викликає мікросудинної захворювання в нирках, яке, як відомо, призводить до стійкої солечувствітельностью гіпертензії. Дійсно, персистуюча гіпертензія може бути викликана фруктозою і високосолевой дієтою у щурів.
Після утворення ФРПФ реакції синтезу пуринових і піримідинових мононуклеотидів різні.
ПРИНЦИПОВІ Відмінності в синтезі пуринових і піримідинових мононуклеотидів:
особливістю синтезу пуринових нуклеотидів є те, що циклічна структура пуринового азотистого підстави поступово добудовується на активній формі рибоза-фосфату, як на матриці. При циклізації виходить вже готовий пуриновий мононуклеотид.
Інші проблеми, пов'язані з сечовий кислотою
Крім того, хронічне вживання фруктози в часі пов'язане з підвищенням рівня голодування в сечі натщесерце, почасти тому, що фруктоза також стимулює синтез сечової кислоти. Також були поставлені під сумнів інші аспекти досліджень сечової кислоти. Однак, хоча сечова кислота є антиоксидантом в позаклітинному середовищі, він має прооксидантних ефектами всередині клітини. Деякі дослідники також припустили, що це не сечова кислота, яка викликає метаболічний синдром, а скоріше ксантиноксидазу, так як цей фермент генерує окислювачі на додаток до сечової кислоти, і це може бути перший, який відповідає за метаболічний синдром.
при синтезі піримідинових мононуклеотидів спочатку утворюється циклічний структура пиримидинового азотистого підстави, яка в готовому вигляді переноситься на рибозу - на місце пірофосфату.
Синтезу пуринових мононуклеотидів (АМФ і ГМФ)
З  уществует 10 загальних і 2 специфічних стадії. В результаті спільних реакцій утворюється пуриновий мононуклеотид, що є загальним попередником майбутніх АМФ і ГМФ - інозінмонофосфат (ІМФ). ІМФ як азотистого підстави содердітся гипоксантин.
уществует 10 загальних і 2 специфічних стадії. В результаті спільних реакцій утворюється пуриновий мононуклеотид, що є загальним попередником майбутніх АМФ і ГМФ - інозінмонофосфат (ІМФ). ІМФ як азотистого підстави содердітся гипоксантин.
Однак це може просто ставитися до відносного переваги алопуринолу для зниження внутрішньоклітинної сечової кислоти, оскільки вона блокує синтез. Останній аргумент відноситься до генетики метаболізму сечової кислоти і фруктози. У той час як деякі генетичні поліморфізм в різних ферментах, що беруть участь у метаболізмі фруктози і перенесення урата, були пов'язані з метаболічним синдромом і гіпертонією, кілька досліджень асоціації генома не могли показати такі асоціації.
Пошук причини діабету типу 2 був головною областю досліджень, оскільки Етьєн Лансер описав цукровий діабет. Хоча потрібно більше досліджень, докази того, що індукована фруктозою гіперурикемія, можливо, відіграють певну роль, набирають силу. З огляду на, що гіперурикемія є ефективним фактором ризику, ми рекомендуємо як основні, так і клінічні дослідження вирішити цю важливу можливість.
Пуриновое кільце будується з СО 2, аспарагінової кислоти, глутаміну, гліцину і серину. Ці речовини або повністю включаються в пуріновим структуру, або передають для її побудови окремі угруповання.
Аспарагінова кислота віддає аміногрупу і перетворюється в фумаровую кислоту.
Гліцин: 1) повністю включається в структуру пуринового азотистого підстави; 2) є джерелом одинвуглецевого радикала.
Сечова кислота: потенційні механізми резистентності до інсуліну і діабет. Урінову кислота також блокує здатність інсуліну стимулювати вазодилатацию кровоносних судин, що важливо для доставки глюкози в кісткову м'яз. Ніяких інших потенційних конфліктів інтересів, що мають відношення до цієї статті, не повідомлялося.
Синтез пуринових дезоксирибонуклеотидов
Написав першу чернетку рукописи. Крім того, всі автори внесли науковий внесок, який послужив основою для цієї перспективи. Оскільки «хвороба багатою» подагри була в минулому. Майже 300 років тому він був майже виключно поширений серед багатих людей, що зробило його одним з найстаріших цивілізаційних захворювань.
Серін: теж є донором одинвуглецевого радикала.
ФРПФ + глутамин -------\u003e глутамат + ФФ + фосфорібозіламін
Фермент, який каталізує цю реакцію, називається фосфорібозіламідотрансфераза. Він є ключовим ферментом синтезу всіх пуринових мононуклеотидів. Регулюється за принципом негативного зворотного зв'язку. Аллостеріческого інгібіторами цього ферменту є АМФ і ГМФ.
На другій стадії фосфорібозіламін взаємодіє з гліцином.
Третя стадія - включення вуглецевого атома, донором якого є гліцин або серин.
Потім добудовується шестичленна фрагмент пуринового кільця:
4-а стадія - карбоксилирование за допомогою активної форми СО 2 за участю вітаміну Н - біотину.
5-а стадія - амінірованіе за участю аміногрупи з аспартату.
6-а стадія - амінірованіе за рахунок аміногрупи глутаміну.
7-а, заключна стадія - включення одинвуглецевого фрагмента (за участю ТГФК), і утворюється готовий ІМФ.
 Потім протікають специфічні реакції, в результаті яких ІМФ перетворюється або в АМФ, або в ГМФ. При такому перетворенні в молекулі з'являється аминогруппа, причому в разі перетворення в АМФ - на місці ОН-групи. При утворенні АМФ джерелом азоту є аспарагінова кислота, а для освіти ГМФ необхідний глутамин.
Потім протікають специфічні реакції, в результаті яких ІМФ перетворюється або в АМФ, або в ГМФ. При такому перетворенні в молекулі з'являється аминогруппа, причому в разі перетворення в АМФ - на місці ОН-групи. При утворенні АМФ джерелом азоту є аспарагінова кислота, а для освіти ГМФ необхідний глутамин.
У деяких тканинах є альтернативний спосіб синтезу - реутилізацію (Повторне використання) пуринових азотистих основ, які утворилися при розпаді нуклеотидів.

Ферменти, що каталізують реакції реутилізацію, найбільш активні в бистроделящіхся клітинах (ембріональні тканини, червоний кістковий мозок, ракові клітини), а також в тканинах головного мозку. На схемі видно, що фермент гуанінгіпоксантінФРПФтрансфераза володіє більш широкої субстратної специфічністю, ніж аденінФРПФтрансфераза - крім гуаніну, може переносити і гіпоксантин - утворюється ІМФ. У людини зустрічається генетичний дефект цього ферменту - "хвороба Леша-Нихана". Для таких хворих характерні виражені морфологічні зміни в головному і кістковому мозку, розумова і фізична відсталість, агресія, аутоагресія. В експерименті на тваринах синдром аутоагрессии моделюється шляхом згодовування їм кофеїну (пурину) у великих дозах, який пригнічує процес реутилізацію гуаніну.
У людини та інших ссавців пуринові нуклеотиди синтезуються для забезпечення потреб організму в мономерних попередників нуклеїнових кислот, а також у з'єднаннях, що виконують інші функції, описані в гл. 34. У деяких хребетних (птахів, земноводних, рептилій) синтез пуринових нуклеотидів несе додаткову функцію - є частиною механізму, за допомогою якого виводяться надлишки азоту у вигляді сечової кислоти; такі організми називають урікотеліческімі. Організми, у яких кінцевим продуктом азотистого обміну є сечовина (як у людини), називають уреотелічеекімі. Оскільки урікотеліческіе організми видаляють «надлишки» азоту у вигляді сечової кислоти, синтез пуринових нуклеотидів у них йде інтенсивніше, ніж у уреотеліческіх. У той же час шляху синтезу пуринових нуклеотидів de novo - загальні для обох груп організмів.
Інформація про походження кожного з атомів в молекулі пуринового підстави отримана в процесі радіоізотопних досліджень, проведених на птахах, щурах і людину (рис. 35.2). На рис. 35.3 представлена схема шляху біосинтезу пуринових нуклеотидів. Перша стадія (реакція 1) - освіту 5-фосфорибозил-1-пірофосфату (ФРПФ). Ця реакція не унікальна для біосинтезу пуринових нуклеотидів. ФРПФ служить також попередником в синтезі піримідинових нуклеотидів (див. Рис. 35.15), він необхідний для синтезу NAD і NADP - двох коферментів, до складу яких входить нікотинова кислота.
Мал. 35.2. Походження атомів азоту і вуглецю пуринового кільця.
В реакції 2 (рис. 35.3), що каталізує фосфорибозил-пірофосфат-амідотрансферази, з ФРПФ і глутаміну утворюються глутамат і 5-фосфорібозіламін. Хоча можливі й інші механізми синтезу 5-фосфорібозіламін, реакція, що каталізується амідотрансферази, має найбільш важливе фізіологічне значення в тканинах ссавців.
Далі 5-фосфорібозйламін вступає в реакцію з гліцином (реакція 5); при цьому утворюється гліцінамідрібозілфосфат (гліцінамідоріботід, ГАР). Амідна група глутаміну служить джерелом атома азоту в положенні 9 молекули пурину (N-9), а гліцин-джерелом атомів вуглецю в положеннях 4 і 5 (С-4 і С-5) пуринового кільця. Цю реакцію каталізує гліцінамід-кіносішегаза. В реакції 4 атом азоту молекули гліцінамід-рибоза фосфату форміліруется В результаті цієї реакції, що каталізується гліцінамід-рибоза-фосфат-формілтрансферазой, що надходить одинвуглецевого фрагмент займе положення С-8 в формується пуриновому підставі. В реакції 5 знову бере участь глутамін - донор амидной групи. Амідування відбувається по атому С-4 формілгліцінамід-рібозілфосфата і каталізується формілгліцінамідін-рібозілфосфатеінтетазой. Приєднаний атом азоту займе в молекулі пурину положення 3.
В результаті замикання імідазольного кільця, катализируемого аміноімндазолрібозілфое-фатсінтетазой, утворюється аміноімідазол-рібозілфосфат (реакція 6). Далі синтез проходить через стадію утворення аміноімідазолкар-боксілат-рібозілфосфата (реакція 7). В результаті реакції формується карбонильная група, джерелом якої служить молекула утворюється в процесі дихання.
Атом азоту в положенні 1 відбувається з а-аміногрупи аспартату (реакція 8), інша частина якого утворює сукцінільний фрагмент в молекулі аміноімідазолсукцінілкарбоксіламід-рібозілфосфата (АІСКАР).
В реакції 9 сукцінільная група АІСКАР видаляється у вигляді фумарату. Що залишився аміноімідазолкарбоксіламід-рібозілфосфат форміліруется (реакція 10) -формілтетрагідрофолатом з утворенням амідоімідазолкарбоксіламід-рібозілфосфата; реакція каталізується відповідної формілтрансферазой. Знову приєднаний атом вуглецю, подібно атому С-8, надходить з пулу одноуглеродних фрагментів за участю тетрагідрофолату і займає в молекулі пурину положення 2.
Замикання кільця (реакція 11) відбувається за допомогою IMP-ціклогідролази, в результаті утворюється перший пуриновий нуклеотид-інозинова кислота (інозінмонофоефат; IMP).
(Див. Скан)
Мал. 35.3. Шлях біосинтезу de novo пуринів з рибоза-5-фосфату і АТР (пояснення - в тексті). або РВ.
Значення метаболізму фолатів
В процесі біосинтезу пуринових нуклеотидів (рис. 35.3) атоми вуглецю в положеннях 8 і 2 надходять відповідно від і -формілтетрагідрофолата. Останній утворюється з тетрагідрофолату, який в свою чергу є продуктом залежного дегідрогенірованія Якщо служить джерелом одноуглеродних фрагментів для багатьох акцепторів, то поставляє одинвуглецевого групу (або безпосередньо, або через стадію утворення тільки в пурини. З наведених відомостей слід, що гальмування процесів утворення розглянутих фолатів надає гальмує вплив і на синтез пуринів de novo.
Освіта АМР і GMP з IMP
Як показано на рис. 35.4 адениновую (реакції 12 і 13) і гуанінових нуклеотиди (реакції 14 і 15) утворюються шляхом амінування і відповідно окислення і амінування загального попередника-інозінмонофоефата (IMP). Амінірованіе ГМР протікає через стадію утворення проміжного з'єднання, в якому аспартат приєднується до инозиновой кислоті, утворюючи аденілосукцінат. Ця реакція нагадує реакцію 8 біосинтезу пуринів (рис. 35.3), в якій а-азот аспарагінової кислоти поставляє атом пуринового кільця. Освіта аденілосукціната каталізується аде-нілосукцінатсінтазой і відбувається за участю GTP. Видалення решти частини аспарагінової кислоти у вигляді фумарату призводить до утворення адениловой кислоти (аденозинмонофосфат; АМР). Відщеплення фумарата від аденілосукціната каталізується ферментом аденілосукціназой. Цей же фермент каталізує відщеплення фумарата від аміноімідазолсукцінілкарбоксамідрібозілфосфата (реакція 9).
Так само, в дві стадії, з IMP утворюється гуанзінмонофосфат (GMP). У першій реакції на цьому шляху (реакція 14) за участю NAD і відбувається окислення IMP з утворенням ксантінмонофосфата (ХМР). Потім ХМР амінується амідогруппой глутаміну (реакція 15). Для цього процесу необхідний АТР, що в якійсь мірі нагадує потреба в GTP при перетворенні IMP в АМР.

Мал. 35.4. Перетворення IMP в АМР і GMP (пояснення в тексті).
Інгібітори біосинтезу пуринів
Кілька антиметаболітів - аналогів глутаміну роблять сильний інгібуючий вплив на біосинтез пуринів. Азасерін (О-діазо-ацетил-b-серин) виступає як антагоніст глутаміну, особливо в реакції 5. Діазонорлейцін блокує реакцію 2, а -меркаптонурін поряд з іншими ефектами інгібує реакції 13 і 14 синтезу АМР і GMP відповідно. Мікофеноловая кислота пригнічує реакцію 14.
Освіта ді-і трифосфатів пуринових нуклеозидів
Перетворення АМР і GMP до відповідних ді-і трифосфати здійснюється в дві стадії (рис. 35.5). Реакції фосфорилювання - перенесення фосфатних груп від АТР-здійснюються нуклеозідмонофосфаткіназой і нуклеозіддіфосфаткііазой.
Синтез пуринових дезоксирибонуклеотидов
Синтез пуринових і піримідинових дезоксирибонуклеотидов відбувається шляхом прямого відновлення 2-вуглецю рібозного залишку відповідного рибонуклеотиду, а не шляхом синтезу de novo з 2 "-дезоксіаналога ФРПФ. Відновлення 2-вуглецевого атома рибози відбувається тільки після перетворення пуринових і піримідинових нуклеотидів в відповідні нуклеозіддіфосфати. У деяких бактерій в цьому відновному процесі бере участь кобаламин (вітамін В12). у тварин процес відновлення йде і під час відсутності вітаміну В12. відновлення риб онуклеозіддіфосфатов в дезоксірібонуклеозіддіфосфати каталізується рибонуклеотидредуктазу і вимагає участі тіоредоксіна (білковий кофактор), тіоредоксінредукчаш (флавопрогеіновий фермент) і NADPH (кофактор). Безпосереднім донором електронів для нуклеотиду є тіоредоксін, який попередньо відновлюється NADPH. Неруйнівна окислювально-відновну перетворення тіоредоксіна каталізується тіоредоксінре-дуктазой. Відновлення рібонуклеозіддіфосфата відновленим тіоредоксіна каталізується рібонуклеоз ідредуктазой (рис. 35.6).

Мал. 35.5. Реакції фосфорилювання нуклеозідмонофосфата і нуклеозіддіфосфата.

Мал. 35.6. Відновлення рібонуклеозіддіфосфата до 2-дезоксірібонуклеозіддіфосфата.
Ця складна ферментна система функціонує в клітинах тільки в період активного синтезу ДНК і поділу.
Тканинна специфічність біосинтезу пуринів
Не у всіх тканинах людини відбувається синтез пуринових нуклеотидів de novo. Еритроцити і поліморфноядерні лейкоцити не здатні синтезувати -фосфорібозіламін, і тому для утворення пуринових нуклеотидів їм необхідні екзогенні пурини. Периферичні лімфоцити здатні синтезувати невеликі кількості пуринів de novo. Встановлено, що в клітинах мозку ссавців містяться дуже малі кількості ФРПФ-амідотрансферази, на цій підставі був зроблений висновок про залежність синтезу пуринових нуклеотидів в мозку від надходження екзогенних пуринів. Виявилося, що основним місцем синтезу пуринових нуклеотидів в організмі ссавців є печінка. З неї вільні підстави або нуклеозиди потрапляють в інші тканини, які не здатні до синтезу пуринів de novo.
Шляхи регенерації пуринових нуклеотидів
Регенерацію пуринових нуклеотидів забезпечують два основних механізми. У кількісному відношенні найбільш важливий механізм фосфорібозілірованіе вільних пуринових підстав ферментами, які використовують ФРПФ в якості донора фосфорибозил. Другий спільний механізм - це фосфорилирование пуринових нуклеозидів по -гід-роксільной групі.
1. фосфорібозілірованіе пуринових підстав
У тканинах людини фосфорібозілірованіе

Мал. 35.7. Фосфорібозілірованіе аденіну, що каталізує аденін-фосфорібозілтрансфераза.
пуринових підстав здійснюють два ферменти. Перший - аденін-фосфорібозілтрансфераза - переносить фосфорибозил з ФРПФ на аденін. При цьому утворюється АМР (рис. 35.7). Другий - гіпокеантін-гуанін-фосфорібозілтрансфераза - каталізує фосфорібозілірованіе ксантина і гуаніну з утворенням IMP і GMP відповідно (рис. 35.8). Процес за участю другого ферменту, як буде показано нижче, протікає більш активно, ніж синтез АМР з аденіну.
2. Фосфорилування пуринових рибонуклеозид
Перетворення пуринових рибонуклеозид в пуринові рибонуклеотиди у людини каталізує фермент аденозинкіназою (рис. 35.9). Аденозинкіназою, крім того, фосфорилирует 2-дезоксиаденозин, вона проявляє також деяку активність по відношенню до гуанозин, інозин та їх 2-дезоксіпроізводним. Дезоксицитидинкіназою на додаток до фосфорилированию -дезоксіцітідіна каталізує фосфорилювання -дезоксіаде-нозіна і -дезоксігуанозіна з утворенням dAMP і dGMP.
Крім того, в тканинах людини функціонує цикл (рис. 35.10), в якому спочатку IMP, GMP і їх дезоксірібонуклеотідние аналоги при дії

Мал. 35.8. Фосфорібозілірованіе гипоксантина і гуаніну до IMP і GMP відповідно. Обидві реакції катализируются гипоксантин-гуанін-фосфорібозілтрансфераза.

Мал. 35.9. Фосфорилювання аденозину до АМР аденозинкіназою.
пурин-5-нуклеотидази перетворюються в відповідні нуклеозиди (інозин, дезоксінозін, гуанозин і дезоксигуанозину), а потім в результаті реакції, що каталізується пуріннуклеозцдфосфорілазой, утворюються гипоксантин або гуанін і продукти фосфоролізарібозо-1-фосфат або 2-дезоксирибоза-1-фосфат. Далі за участю ФРПФ цикл завершується фосфорібозілірованіе утворилися підстав до IMP або GMP. Функція цього циклу невідома, однак не викликає сумнівів, що споживання ФРПФ в організмі людини в даному циклі вище, ніж при синтезі пуринових нуклеотидів de novo.
Бокову колію цього циклу включає перетворення IMP в АМР (реакція 12 і 13, рис. 35.4) і подальшу реакцію освіти аденозину з АМР. Ця реакція, мабуть, каталізується тієї ж пурин-5-нуклеотидаза, яка гідролізує IMP до інозину. Утворився аденозин потім або фосфорилируется аденозинкіназою до АМР, або під дією аденозіндезамінази перетворюється в инозин. У кількісному відношенні ця «інозит-нова петля» менш значима, ніж описаний вище цикл, проте реакція дезамінування аденозину дуже важлива для функціонування імунної системи.
Регуляція біосинтезу пуринів
На синтез молекули IMP витрачається енергія гідролізу шести макроергічних фосфодіефірних зв'язків АТР, при цьому в якості попередників виступають гліцин, глутамін, метенілтетрагідрофолат і аспартат. Для економії енергетичних і поживних ресурсів важлива ефективна регуляція процесу біосинтезу пуринів de novo. найважливішу
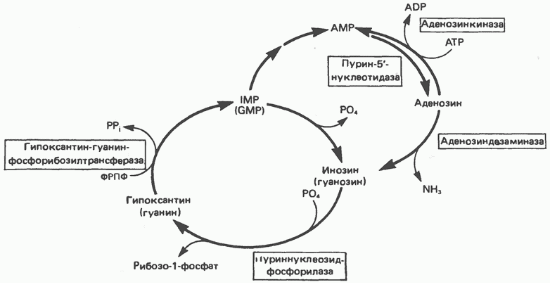
Мал. 35.10. Цикли реутилізацію пуринів, що включають взаємні перетворення AMP, IMP і, в меншій мірі, GMP; утворення відповідних рибонуклеозид і їх перетворення в пуринові рибонуклеотиди. Дезоксиаденозин, дезоксіінозін і дезоксигуанозину перетворюються на ті ж шляхами; дезоксиаденозин і дезоксигуанозину можуть безпосередньо фосфорильованій до dAMP і dGMP відповідно.
роль в цьому процесі відіграє внутрішньоклітинна концентрація ФРПФ. Вона визначається співвідношенням швидкостей його синтезу, утилізації та деградації. Швидкість синтезу ФРПФ залежить від 1) наявності субстратів синтезу, особливо рибоза-5-фосфату, і 2) каталітичної активності ФРПФ-синтази, яка в свою чергу пов'язана з внутрішньоклітинної концентрацією фосфатів, а також з концентрацією пуринових і піримідинових рибонуклеотидов, які виступають в ролі аллостеріческіх регуляторів (рис. 35.11). Швидкість утилізації ФРПФ в значній мірі залежить від інтенсивності циклу реутилізацію пуринових підстав, в ході якого ксантин і гуанін фосфорібозіліруются до відповідних рибонуклеотидов. У меншій мірі швидкість утилізації ФРПФ залежить від інтенсивності синтезу пуринів de novo. Цей висновок грунтується на наступному спостереженні: в еритроцитах і культивованих фібробластах чоловіків зі спадковим порушенням активності гіпоксантин-гуанін-фосфо-рібозілтрансферази рівень ФРПФ підвищується в кілька разів.

Мал. 35.11. Регуляція швидкості синтезу пуринів de novo. Суцільні лінії вказують шлях хімічних перетворень. Пунктирні лінії позначають інгібування кінцевими продуктами за принципом зворотного зв'язку.

Мал. 35.12. Регуляція перетворень IMP в аденозинові і гуанозінових нуклеотиди. Суцільні лінії вказують шлях хімічних перетворень. Пунктирні лінії позначають позитивну і негативну регуляцію за принципом зворотного зв'язку.
Показано, що ФРПФ-амідотрансферази - перший з ферментів, які беруть участь в процесі синтезу пуринових нуклеотидів de novo, відзначено зниження in vitro пуриновими нуклеотидами (особливо аденозинмонофосфат і гуанозинмонофосфат) за принципом зворотного зв'язку. Ці інгібітори конкурують з субстратом - ФРПФ, останній, як з'ясувалося, займає центральне місце в регуляції синтезу пуринів de novo. Багато непрямі дані свідчать про те, що роль амідотрансферази в цьому процесі менш істотна, ніж ФРПФ-синтетази.
Освіта GMP або АМР з IMP регулюється двома механізмами (рис. 35.12). АМР регулює активність аденілосукцінатсінтетази, впливаючи за принципом зворотного зв'язку на власний синтез. GMP регулює власний синтез, діючи за тим же принципом на -дегідрогеназу. Поряд з цим освіту аденілосукціната з IMP на шляху до АМР стимулюється GTP. А освіта GMP з ксантозінмонофосфата вимагає присутності АТР. Таким чином, спостерігається істотна перехресна регуляція дівергентних шляхів метаболізму IMP. Така регуляція гальмує біосинтез одного з пуринових нуклеотидів при нестачі іншого. Гіпоксантин-гуанін-фосфор-бозілтрансфераза, що каталізує утворення з ксантина і гуаніну IMP і GMP відповідно, дуже чутлива до інгібірує цих нуклеотидів.
Відновлення рібонуклеозіддіфосфатов до дезоксірібонуклеозідціфосфатов є об'єктом складної регуляції. Цей процес (рис. 35.13) забезпечує збалансоване утворення дезоксирибонуклеотидов для синтезу ДНК.

Мал. 35.13. Регуляція відновлення пуринових і піримідинових рибонуклеотидов до відповідних -дезоксірібонуклеотідов. Суцільні лінії вказують шлях хімічних перетворень Пунктирні лінії позначають позитивну і негативну регуляцію за принципом зворотного зв'язку.
катаболізм пуринів
Кінцевий продукт катаболізму пуринів у людини - сечова кислота. При обстеженні хворих із спадковою формою недостатності ферментних систем катаболізму пуринів встановлено, що 99% сечової кислоти утворюється з субстратів нуклеозідфосфорілази, що функціонує в циклі реутилізацію пуринів. Пуринові продукти нуклео-зідфосфорілазной реакції - гипоксантин і гуанін - перетворюються в сечову кислоту; проміжним продуктом є ксантин, утворюється в реакціях, що каталізуються гуаназой і ксантінокеідазой (див. рис. 35.1) в печінці, тонкому кишечнику і нирках.
Ксантиноксидаза являє собою важливу мету для фармакологічного втручання при гіперурикемії і подагри. У нижчих приматів і інших ссавців (але не в людини) сечова кислота гідролізується уриказа до аллантоина (рис. 35.14) - з'єднання, добре розчинної у воді. У птахів і наземних рептилій уриказа відсутня; в якості кінцевих продуктів метаболізму азоту (білків) і пуринів вони екскретують сечову кислоту і гуанін.
У цих організмів сформувалася урікотеліческая система, що дозволяє зберегти воду, асоційовану з сечовий кислотою, при виділенні останньої у вигляді преципітату. Якби кінцевим продуктом метаболізму азоту у них була сечовина, зберегти гідратаційну воду було б неможливо, оскільки розчинність сечовини у воді досягає 10 моль / л (концентрація значно вища за ту, яка може бути досягнута при концентруванні сечовини нирками).
Метаболізм сечової кислоти у людини (подагра)
Метаболізм сечової кислоти у людини був вивчений із застосуванням изотопно-мічених сечової кислоти, а також її попередників-гліцину і форміату. [-Мочевую кислоту ін'єктували внутрішньовенно здоровим людям і хворим на подагру, при якій в організмі накопичуються значні кількості сечової кислоти і її натрієвої солі. З розведення ін'єктувати ізотопу розраховували загальна кількість сечової кислоти, що знаходиться у водній фазі організму. Цей параметр отримав назву «розчинний уратний пул». Середня величина даного показника для 25 обстежених здорових дорослих чоловіків становила 1200 мг (розкид 866-1578 мг), а у трьох здорових жінок він коливався від 541 до 687 мг. У хворих на подагру розчинний уратний пул був значно вище і варіював від 2000 до 4000 мг для пацієнтів без подагричних вузлів, т. Е. Без відкладень урати натрію в м'яких тканинах. При важкій формі подагри, що супроводжується утворенням вузлів, розчинний уратний пул досягав величини 31 000 мг. Швидкість його поновлення у здорових людей становить 600 мг за 24 год. 18-20% видаляється з організму сечової кислоти розпадається до і

Мал. 35.14. Освіта аллантоина з сечової кислоти.
аміаку і виділяється через кишечник. Деяка кількість уратів екскретнруется з жовчю і піддається деградації кишкової мікрофлорою. Слід зазначити, що розпад сечової кислоти до у людини не пов'язаний з життєдіяльністю кишкових бактерій.
Значення уратів для організму людини не обмежується їх роллю кінцевого продукту в метаболізмі пуринів. Урати можуть функціонувати як антиоксиданти, зазнаючи неферментативне перетворення в алантоїн. Передбачається, що ендогенний антиоксидант - урат - замінює у приматів аскорбат, здатність до синтезу якого у цих ссавців втрачена. Таким чином, цілком можливо, що в процесі еволюції втрата уриказа забезпечила певні селективні переваги для тих організмів, які втратили здатність до відновлення гулонолактона в аскорбат.
Урат натрію легко фільтрується нирковими клубочками ссавців, інтенсивно реабсорбується і частково виводиться в проксимальних канальцях, потім секретується в петлі Хенлі і, ймовірно, знову реабсорбується в дистальних канальцях. За добу здоровою людиною виділяється 400-600 мг сечової кислоти. Велика кількість фармакологічних препаратів і природних сполук впливає на реабсорбцію урати натрію в ниркових канальцях і його екскрецію. Аспірин у великих дозах пригнічує як екскрецію, так і реабсорбцію сечової кислоти в нирках.
